- Lexikon
- Chemie Abitur
- 10 Anwendungen der Chemie
- 10.5 Ausgewählte technisch - chemische Verfahren
- 10.5.4 Technische Herstellung von Chlor und Natronlauge - Chloralkali-Elektrolyse nach dem Membranverfahren
- Technische Varianten der Chloralkali-Elektrolyse
Technische Varianten der Chloralkali-Elektrolyse
Die ältesten Verfahren der Chloralkali-Elektrolyse sind das Diaphragma-Verfahren und das Amalgamverfahren, sie wurden beide bereits Ende des 19. Jahrhunderts eingeführt. Die dritte Variante, der Membranprozess, wurde erst um das Jahr 1970 technisch realisiert. Obwohl prinzipiell dieselben Endprodukte hergestellt werden, laufen bei den einzelnen Verfahren zum Teil verschiedene Elektrodenreaktionen ab, woraus sich ein unterschiedlich hoher Energieaufwand für die Elektrolyse ergibt.
Elektrodenprozesse und Überspannungen
1. Katode:
Elektrolysiert man eine wässrige Lösung von Natriumchlorid, so können an der Katode theoretisch Wasserstoff oder Natrium abgeschieden werden.
Das Standardredoxpotenzial für die Wasserstoffabscheidung ist weniger negativ als das für die Abscheidung von Natrium, daher sollte in wässriger Lösung unabhängig vom pH-Wert Wasserstoff gebildet werden (Gleichungen 1 bzw. 2).
Die Standardredoxpotenziale beschreiben jedoch nur die thermodynamischen Gegebenheiten. Wie alle chemischen Reaktionen haben aber auch elektrochemische Reaktionen eine Aktivierungsenergie und damit einen kinetischen Aspekt. Die Aktivierungsenergie macht sich im Auftreten einer sogenannten Überspannung bemerkbar, die über das Standardredoxpotenzial hinaus angelegt werden muss, damit die Elektrodenreaktion tatsächlich ablaufen kann. Das Potenzial, bei dem sich ein Produkt an der Elektrode abscheidet, ergibt sich folglich aus dem Redoxpotenzial E und dem Überspannungseffekt .
Die Größe der Überspannung hängt u. a. stark vom Elektrodenmaterial ab. Beispielsweise ist die Überspannung für die Abscheidung von Wasserstoff an sogenanntem platinierten Platin, d. h. Platin, das mit feinverteiltem Platin bedeckt ist, nur 0,02 V, an Quecksilber hingegen beträgt sie 1,0 bis 1,2 V.
Beim Diaphragma- und dem Membranverfahren verwendet man eine Eisen- oder Nickelkatode, an der die Überspannung von Wasserstoff einen Wert von 0,4 bis 0,8 V hat. Hier wird gemäß Gleichung 1 bzw. 2 Wasserstoff abgeschieden.
Beim Amalgam-Verfahren hingegen wird als Katodenmaterial Quecksilber eingesetzt. Durch die hohe Überspannung, die hier auftritt, wird das Potenzial für die Wasserstoffabscheidung sehr stark negativ verschoben und die Wasserstoffbildung somit erschwert.
Hinzu kommt, dass sich, wenn Natrium an Quecksilber abgeschieden wird, eine Legierung bildet, das Natriumamalgam. Dadurch wird zusätzlich das Potenzial für die Natriumabscheidung positiv verschoben:
Insgesamt ist folglich das Potenzial für die Abscheidung von Natrium an Quecksilber positiver als für die Wasserstoffabscheidung, sodass beim Amalgamverfahren Natrium gebildet wird.
2. Anode:
Betrachtet man die möglichen Prozesse an der Anode, so können dort theoretisch Sauerstoff oder Chlor abgeschieden werden.
Die Redoxpotenziale für Reaktion (6), die den Bedingungen bei der Elektrolyse entspricht, und für Reaktion (8) sind nahezu gleich. Damit sollten sowohl Chlor als auch Sauerstoff nebeneinander gebildet werden. Das Abscheidepotenzial für Sauerstoff wird aber durch Überspannungseffekte stärker ins Positive verschoben, als das bei Chlor der Fall ist. So betragen z. B. die praktischen Abscheidepotenziale an einer Grafitelektrode für Sauerstoff 1,91 V und für Chlor 1,68 V. Daher wird in der Praxis bei der Elektrolyse Chlor abgeschieden, das je nach Verfahren bis zu 2% Sauerstoff als Verunreinigung enthalten kann. Für besondere Anwendungen muss dieses Produktgemisch einer speziellen Chlorreinigung unterzogen werden.
Die gleichzeitige Bildung von Chlor und Wasserstoff beim Diaphragma- und beim Membranverfahren erfordert eine strikte Trennung von Anoden- und Katodenraum. Dies ist notwendig, damit und sich nicht vermischen können, denn die Mischung, die auch Chlor-Knallgas genannt wird, reagiert explosionsartig zu Chlorwasserstoff. Weiterhin ist auch die Vermischung von Chlor mit den gebildeten Hydroxid-Ionen unerwünscht, da diese miteinander zu Hypochlorit reagieren.
Die unterschiedlichen Verfahren
Allen Verfahren ist gemeinsam, dass als Koppelprodukte Chlor, Wasserstoff und Natronlauge entstehen.
Sehr ähnlich sind sich das Diaphragma- und das Membranverfahren, bei denen dieselben elektrochemischen Reaktionen ablaufen. Hier entstehen an den Elektroden direkt Chlor und Wasserstoff, Natronlauge bleibt im Katodenraum zurück.
Wesentliche Unterschiede zwischen den drei Verfahren bestehen im verwendeten Elektrodenmaterial, das die ablaufenden elektrochemischen Reaktionen und damit auch den Energieverbrauch bestimmt.
Außerdem unterscheiden sich die Verfahren in der technischen Umsetzung der Trennung von Anoden- und Katodenraum, die entscheidend ist für die Reinheit und Konzentration der gebildeten Natronlauge.
Ökologisch betrachtet sind sowohl das beim Amalgam-Verfahren verwendete Quecksilber als auch Asbest, aus dem das Diaphragma besteht, problematisch. In dieser Hinsicht ist das Membranverfahren den beiden anderen vorzuziehen. Da dieses außerdem den besten energetischen Wirkungsgrad aufweist, gewinnt es zunehmend an Bedeutung.
Wie wichtig es ist, für die Chloralkali-Elektrolyse energiesparende Verfahren zu nutzen, zeigt die Tatsache, dass in der BRD etwa 3 % der insgesamt produzierten Elektroenergie dafür verbraucht werden.
![]()
Technische Werte der Verfahren im Vergleich
Diaphragma-Verfahren
Beim Diaphragma-Verfahren (Bild 3) sind Anodenraum und Katodenraum der Elektrolysezelle durch ein Diaphragma aus Asbest getrennt. Dieses Material ist im Dauerbetrieb bei 90 - 100 °C Betriebstemperatur beständig gegen Natronlauge, Chlor und konzentrierte Natriumchlorid-Lösung.
Es ist undurchlässig für Gase, somit können anodisch gebildetes Chlor und katodisch gebildeter Wasserstoff nicht in der Chlorknallgasreaktion miteinander reagieren. Wasser und darin gelöste Ionen können aber das Diaphragma passieren.
In den Anodenraum wird kontinuierlich eine konzentrierte NaCl-Lösung (ca. 300 g/l) eingeleitet. Störende Fremdionen (Ca, Mg, Fe), die in geringen Mengen im geförderten NaCl als Verunreinigungen enthalten sind, werden vorher ausgefällt.
An der Anode aus beschichtetem Titan-Metall wird nur ein Teil der Chlorid-Ionen zu Chlor umgesetzt.
![]()
Da der Flüssigkeitsspiegel im Anodenraum höher gehalten wird als im Katodenraum, fließt die Lösung ständig durch das Diaphragma hindurch in den Katodenraum. Das Diaphragma ist durchlässig für Natrium- und Chlorid-Ionen, sodass die an der Anode nicht umgesetzten Chlorid-Ionen mit in den Katodenraum gelangen. Umgekehrt können auch Hydroxid-Ionen in den Anodenraum gelangen und dort elektrolytisch zu Sauerstoff reagieren. Um dies zu verhindern darf die Konzentration der Hydroxid-Ionen nicht zu hoch werden, herstellbar ist nur eine ca. 15%ige Natronlauge.
An der Katode aus Eisen läuft folgende Reaktion ab:
Die aus dem Katodenraum kontinuierlich entnommene Natronlauge enthält aufgrund der Ionenwanderung durch das Diaphragma sehr viel Natriumchlorid (130 g/l NaOH, 190 g/l NaCl). Beim Eindampfen der Natronlauge auf etwa 50% fällt der größte Teil des NaCl aus, das in den Prozess zurückgeführt wird. In der so gewonnenen 50%igen Natronlauge verbleiben aber immer noch Restmengen von etwa 1% NaCl. Bei zahlreichen Anwendungen der Lauge stört das nicht, für einige Verwendungsgebiete von Natronlauge, wie bei der Celluloseverarbeitung, ist chloridhaltige Natronlauge aber ungeeignet. Es ist zwar prinzipiell möglich, das NaCl fast vollständig aus der Natronlauge abzutrennen, das ist aber sehr aufwändig.
Schema des Diaphragmaverfahrens
Amalgamverfahren
Beim Amalgamverfahren (Bild 4) nutzt man die hohe Überspannung für die Wasserstoffabscheidung an Quecksilber als Katodenmaterial und die Verschiebung des Abscheidepotenzials für Natrium aus, um Natrium anstelle von Wasserstoff katodisch abzuscheiden.
In die Zelle wird ebenfalls kontinuierlich eine konzentrierte NaCl-Lösung (ca. 300 g/l) eingeleitet.
An der Anode aus beschichtetem Titan-Metall oder Grafit wird ein Teil der Chlorid-Ionen zu Chlor umgesetzt.
![]()
Aus der Zelle fließt eine NaCl-Lösung geringerer Konzentration (250 - 270 g/l), die mit festem Salz wieder auf die Ursprungskonzentration gebracht wird und den Kreislauf durchläuft.
Die Zelle besitzt einen schwach geneigten Boden, über den Quecksilber in einer dünnen Schicht fließt, es wird am oberen Ende ständig zugeführt und unten abgeführt. Am Quecksilber als Katode werden die Natrium-Ionen reduziert, das Natrium bildet mit Quecksilber eine Legierung - Natriumamalgam
Der Natriumgehalt im Quecksilber darf aber nur sehr gering sein (0,2 -0,4%), damit das Quecksilber noch fließfähig bleibt. Bei höheren Gehalten ist Natriumamalgam fest.
Das amalgamhaltige Quecksilber fließt dann in den Zersetzerturm, in den von unten im Gegenstrom Wasser eingeführt wird. Der Zersetzer ist mit Grafitkörpern gefüllt, an deren Oberfläche die Zersetzung des Amalgams - katalysiert durch Grafit - stattfindet.
Das amalgamfreie Quecksilber wird vom unteren Teil des Turms in die Zelle zurück gepumpt.
Am oberen Ende des Turmes werden der entstandene Wasserstoff und eine praktisch chloridfreie etwa 50%-ige Natronlauge entnommen. Der Vorteil gegenüber dem Diaphragmaprozess und dem Membranverfahren liegt in der Gewinnung von konzentrierter chloridfreier Natronlauge ohne zusätzliche Eindampf-Stufe.
Das Problem beim Amalgamverfahren ist aber, dass metallisches Quecksilber im Gegensatz zu anderen Metallen in Wasser etwas löslich und zudem sehr flüchtig ist. Insbesondere Natronlauge und Wasserstoff enthalten daher Quecksilber und müssen aufwändig von diesem gereinigt werden. Die Anlagen zur Quecksilberentfernung aus allen Medien beim Amalgamprozess erfordern etwa 10 % der Baukosten. Weiterhin fallen bei diesem Verfahren quecksilberhaltige feste Abfälle an, die in Untertage-Deponien entsorgt werden müssen.
Durch konsequente Minderungsmaßnahmen sind die Quecksilber-Emissionen durch das Amalgam-Verfahren in der BRD in den letzten Jahrzehnten drastisch reduziert worden (von etwa 65 g Hg/Tonne Chlor im Jahr 1970 reduzierte sich die Hg-Emission in Deutschland und ganz Europa auf ca. 0,9 g je Tonne im Jahr 2008). Der Anteil des Amalgam-Prozesses an den Gesamt-Quecksilber-Emissionen in die Umwelt lag damit 2005 in der BRD bei etwa 5 %.
Schematische Darstellung des Amlaganverfahrens
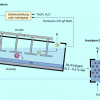
Membranverfahren
Das Membranverfahren zur Chloralkali-Elektrolyse (Bild 5) ist das modernste Verfahren. Es verbindet die Vorteile der anderen beiden Verfahren. Da die Membran undurchlässig für Chlorid-Ionen ist, liefert es ohne zusätzlichen Reinigungsaufwand eine praktisch chloridfreie Natronlauge, die allerdings nur ca. 33%ig ist, und benötigt kein Quecksilber. Auch die Bau- und Betriebskosten liegen hier etwas günstiger als bei den anderen beiden Verfahren. Ein Nachteil ist zur Zeit noch der hohe Preis der Membranen.
Heute werden neue Anlagen nur nach dem Membranverfahren gebaut und die Anlagen nach den beiden anderen Prozessen werden nach und nach durch Membran-Anlagen ersetzt.
Der Anteil des Membran-Verfahrens an der Chlorproduktion hat in den letzten 20 Jahren ständig zugenommen und lag 2010 in Deutschland und auch weltweit bei ca. 60 %, hingegen ging die Bedeutung des Amalgamprozesses in dem Zeitraum stark zurück.
Anteil der Verfahren an der Chlorproduktion in Europa in %:
| Membran | Amalgam | Diaphragma | sonstige | |
| 1995 | 10 | 62 | 25 | 3 |
| 2000 | 20 | 55 | 22 | 3 |
| 2009 | 52 | 30 | 15 | 3 |
Neue Entwicklungen
Die neueste technische Entwicklung ist der Einsatz einer Sauerstoffverzehrkatode.
Beim Membranverfahren entsteht an der Katode Wasserstoff gemäß
4 H2O + 4 e- –→ 2 H2 + 4 OH- E0 = -0,83 V
Verzichtet man auf die Gewinnung von Wasserstoff und leitet Sauerstoff in den Katodenraum ein, findet dort folgende Reaktion statt:
2 H2O + O2 –→ 4 OH- E0 = +0,40 V
Damit ist die Spannungsdifferenz zwischen der anodischen Chlorabscheidung und dem Katodenprozess theoretisch um 1,23 V geringer als beim Membranverfahren, in der Praxis erreicht man ca. 1 V.
Anstelle von 3 V reicht nun eine Zellspannung von 2 V für die Elektrolyse aus. Damit kann etwa ein Drittel der für den Prozess benötigten Elektroenergie eingespart werden.Die erste technische Anlage, die nach diesem Prinzip arbeitet, geht 2011 in Deutschland in Betrieb. Für die Chlorgewinnung aus Salzsäure wird dieses Verfahren bereits eingesetzt.
Schema des Membranverfahrens
Rechtliches
Ein Angebot von


