Kalorimetrische Messungen
Mithilfe kalorimetrischer Messungen lassen sich Wärmekapazitäten von Stoffen, Verbrennungswärmen oder der physiologische Brennwert von Nahrungsmitteln bestimmen. Verbrennungswärmen ermittelt man häufig in einfachen Bombenkalorimetern mit konstantem Volumen. Das Kalorimeter ist so aufgebaut, dass weder Energie noch Arbeit mit der Umgebung ausgetauscht werden können und stellt somit ein abgeschlossenes System dar (Bild 1).
Die zu untersuchende Substanz wird in die kalorimetrische Bombe gebracht und dort unter Sauerstoffatmosphäre verbrannt. Die Bombe steht in einem Kalorimetergefäß, das mit Wasser gefüllt ist. Die bei der Verbrennung frei werdende Wärme wird vom Wasserbad des Kalorimeters aufgenommen, wodurch sich die Temperatur des Wassers erhöht. Aus der gemessenen Temperaturänderung kann man die Verbrennungswärme nach der Grundgleichung der Wärmelehre berechnen.
Dazu muss man vor der Messung die Wärmekapazität des Kalorimeters ermitteln. Diese erhält man, indem man z. B. eine bestimmte Menge kaltes Wasser in ein Kalorimeter füllt, eine definierte Menge warmes Wasser dazugibt und die Mischungstemperatur bestimmt. Aus der Energiebilanz lässt sich die Wärmekapazität des Kalorimeters folgendermaßen berechnen:
Ein Nachteil des Bombenkalorimeters besteht darin, dass man die Wärme bei konstantem Volumen misst. Diese entspricht der Änderung der inneren Energie und nicht der Änderung der für thermodynamische Berechnungen interessanteren Enthalpie. Allerdings lässt sich die Verbrennungsenthalpie aus nach folgender Näherungsgleichung berechnen:
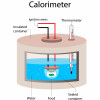
Kalorimeter
Auf die gleiche Weise lässt sich auch der physiologische Brennwert von Kohlenhydraten oder anderen Nährstoffen ermitteln. Die Verbrennungsenthalpie entspricht der bei der Zellatmung frei werdenden Energie. Der experimentell bestimmte Wert wird allerdings auf 1 g des analysierten Stoffes bezogen.
Beispiel (Glucose):
1 mol Glucose wiegt 180 g
Brennwert = 2836 kJ : 180 g = 15,7 kJ/g
Die Enthalpie chemischer Reaktionen ist die Reaktionswärme bei konstantem Druck. Diese kann in speziellen Kalorimetern, z. B. in Flammenkalorimetern direkt bestimmt werden. Flammenkalorimeter sind so konstruiert, dass bei der Verbrennung der Druck konstant gehalten wird.
Mittels Kalorimetrie können trotzdem nicht alle Reaktionswärmen bestimmt werden. Die untersuchten Prozesse müssen schnell und vollständig verlaufen. Außerdem muss die Temperaturänderung des Wasserbades groß genug sein, da ansonsten das Ergebnis der Messung zu ungenau wird.
Rechtliches
Ein Angebot von


